الجدول الدوري الحديث للعناصر (استخداماته وخواص عناصره)
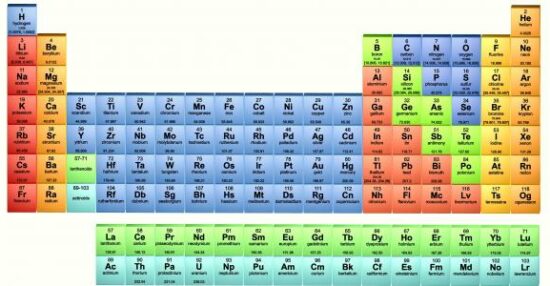
الجدول الدوري الحديث للعناصر هو جدول ترتيب للعناصر الكيميائية مرتبة حسب أعدادها الذرية وتوزيعاتها الإلكترونية وخصائصها الكيميائية المتكررة ، لذا دعونا نتعرف معًا على أهم المعلومات حول الجدول الدوري الحديث للعناصر من خلال هذه المقالة من خلال موقع موجز مصر.
يمثل الجدول الدوري الحديث الاتجاهات الدورية بشكل عام بحيث يتم وضع العناصر التي لها نفس السلوك الكيميائي في عمود واحد ، وتُعرف صفوف الجدول باسم الحلقات ، وتُعرف الأعمدة بالمجموعات.
يستخدم الجدول الدوري المنظم لاشتقاق العلاقات بين العناصر الكيميائية المختلفة بالإضافة إلى الخصائص الكيميائية المتوقعة وسلوك العناصر غير المستكشفة أو المكونة حديثًا.
كما أنه مفيد لتحليل التفاعلات الكيميائية ولا يزال يستخدم على نطاق واسع في الكيمياء والفيزياء النووية والعديد من العلوم الأخرى.
كان الكيميائي الروسي ديمتري مندليف أول من نشر الجدول الدوري ، وكان ذلك في عام 1869 م ، وبعد ذلك قام بالعديد من التطورات لتوضيح الاتجاهات الدورية للعناصر المعروفة في ذلك الوقت.
تم توسيع فكرة مندليف بعد اكتشاف عناصر جديدة أو تصنيعها مسبقًا ، وطور نماذج نظرية جديدة تمكنه من شرح السلوك الكيميائي.
لإجراء تحقيق كامل حول الذرة ، وبنية الذرة ، ومراحل الاكتشاف ونظريات الذرة ، نقترح عليك مراجعة المقالة التالية: تحقيق كامل للذرة ، وهيكل الذرة ، ومراحل الاكتشاف ونظريات الذرة.
هيكل الجدول الدوري
يمثل الجدول الدوري مجموعة من العناصر الكيميائية ، ويحتوي كل عنصر على عدد ذري (z) يمثل مجموعة من البروتونات في نواته ، وتحتوي معظم العناصر على عدد مختلف من النيوترونات مع ذرات مختلفة تسمى النظائر.
في الجدول الدوري القياسي ، يتم سرد العناصر بترتيب زيادة عددها الذري ، ويبدأ كل صف جديد (دورة) عندما يتلقى غلاف التكافؤ الجديد أول إلكترون ، ويتم تحديد الأعمدة (المجموعات) بالتوزيع الإلكتروني للذرة وجميع العناصر التي لها نفس العدد من الإلكترونات عند مستوى أدنى. معين على نفس الأعمدة.
العناصر ذات الخصائص الكيميائية المتشابهة تقع في نفس المجموعة في الجدول الدوري ، والعناصر في نفس الدورة في sub-f لها خصائص مماثلة ، مما يجعل من السهل التنبؤ بالخصائص الكيميائية لعنصر إذا تم التعرف على خصائص العناصر المحيطة.
المجموعات وطريقة ترقيم الجدول الدوري
المجموعة في الجدول الدوري عبارة عن عمود رأسي ، وهناك 18 مجموعة في الجدول ، وجميع العناصر في كل مجموعة لها نفس هيكل غلاف التكافؤ من حيث عدد الإلكترونات ، مما يعطي العناصر خصائص متشابهة.
يتميز الجدول الدوري بالترتيب الصحيح للعناصر الكيميائية ، لأنه كلما انتقلنا من خط إلى آخر ، زاد عدد الطبقات لدينا ، وكلما انتقلنا من عمود إلى آخر ، زاد عدد الإلكترونات في الطبقة الخارجية.
يوجد 3 أنظمة لمجموعات ترقيم الجدول الدوري وهي الأرقام العربية أو الأرقام الرومانية أو مزيج من الأرقام الرومانية والحروف اللاتينية ، وقد تم اختيار الترقيم العربي من قبل الرابطة الدولية للكيمياء والكيمياء التطبيقية.
تم تطوير هذا النظام الذي اقترحه IUPAC ليحل محل الأرقام الرومانية وتسبب في حدوث ارتباك لأنها تستخدم نفس الأسماء لمعاني مختلفة.
تاريخ الجدول الدوري
قبل الميلاد في عام 330 ، قام أرسطو بتقييم أربعة عناصر فقط: الأرض والهواء والنار والماء ، وفي عام 1770 بعد الميلاد صنف لافوازييه 33 عنصرًا والفرق بين المعادن واللافلزات ، وفي عام 1828 قام بعمل جدول للعناصر وأوزانها الذرية وحدد العناصر برموزها الكيميائية. .
في عام 1829 ، رتب دوبرينر 3 جداول تحتوي على 3 مجموعات ، كل منها يحتوي على 3 عناصر ذات خصائص متشابهة: المجموعة الأولى تحتوي على الليثيوم والصوديوم والبوتاسيوم ، والمجموعة الثانية تحتوي على الكالسيوم والسترونتيوم والباريوم ، والمجموعة الثالثة تحتوي على الكلور والبروم واليود.
في عام 1864 ، رتب جون نيولاندز 60 عنصرًا وفقًا لأوزانهم الذرية ، والعنصر الأول والعنصر التاسع والعنصر الثاني والعنصر العاشر ، إلخ. وجد أوجه تشابه بين ، لذلك اقترح قانون الأوكتاف.
لعب ديمتري مندليف دورًا رئيسيًا في تطوير الجدول الدوري ووصفه بأنه أبو الجدول الدوري ، ليس فقط في تنظيم الجدول ولكن أيضًا كتابة مجلدين بعنوان مبادئ الكيمياء ، واستمر رحلته البحثية حتى وفاته في 20 يناير 1907 م.
تم اقتراح الجدول الدوري الأصلي دون التعرف على التركيب الداخلي للذرات ، وبعد ذلك لاحظ الكيميائي البريطاني جون نيولاندز أن العناصر ذات الخصائص المتشابهة تتكرر بشكل دوري بمقدار 8 عناصر.
في عام 1869 ، وضع الألماني يوليوس لوثر ماير والكيميائي الروسي دميتري مندليف أول جدول دوري لترتيب العناصر حسب الكتلة.
قام منديليف بتغيير موضع بعض العناصر حيث تم محاذاة موقعها الجديد مع العناصر الجديدة بجانبها ، وصحح بعض الأخطاء في وضع بعض العناصر وفقًا لقيم الكتل الذرية ، متنبئًا بمكان وجود بعض العناصر غير المكتشفة ، وتم التحقق من جدوله لاحقًا. اكتشاف الهيكل الإلكتروني في القرنين التاسع عشر والعشرين.
لمعرفة ما هو العدد الذري؟ ما هو الجدول الدوري؟ ما هو الفرق بين العدد الذري والعدد الكتلي؟ نقترح عليك إلقاء نظرة على هذا المقال: ما هو العدد الذري؟ ما هو الجدول الدوري؟ ما هو الفرق بين العدد الذري والعدد الكتلي؟
لوحة منديليف
حاول العالم الروسي Mendeleev تصنيف عناصر الجدول الدوري ، ملاحظًا أن بعض العناصر لها خصائص كيميائية وفيزيائية متشابهة ، واعتبر Mendeleev هذا التشابه مفتاحًا للكشف عن الأنماط المخفية في العناصر.
من هناك ، كتب البطاقات التي كتب عليها العناصر والحقائق الثابتة ، وصنع كل عنصر ، بطاقة بنقطة الانصهار ، والكثافة ، واللون ، والوزن الذري لبذرة كل عنصر ، بالإضافة إلى قوة تركيبة كل عنصر وعدد الروابط التي يمكن أن يشكلها كل عنصر.
عندما انتهى منديليف من كتابة البطاقات ، حاول تصنيفها بطرق مختلفة وفي ذلك الوقت لاحظ أن الأنماط ظهرت من خلال ترتيب هذه العناصر وفقًا لزيادة الكتلة الذرية أو الوزن الذري ، ولاحظ أن قوة الترابط بين العناصر من الليثيوم إلى الفلور تتغير بانتظام.
اللوحات الحديثة
تحمل جميع الجداول الحديثة نفس المعلومات التي وضعها منديليف على مكتبه.في الجداول الحديثة ، يتم ترتيب العناصر ذات الخصائص المتشابهة في شكل أعمدة طولية تعرف باسم المجموعات أو العائلات ، وتقدر في 18 مجموعة.
تحتوي المجموعة 1 في الجدول على معادن ناعمة تتفاعل بقوة مع الماء لإطلاق غاز الهيدروجين ، والذي يرتب العناصر في الجدول الدوري من اليسار إلى اليمين ومن أعلى إلى أسفل.
يحتوي الجدول على أكثر من 92 عنصرًا طبيعيًا فوق سطح الأرض والعديد من العناصر الصناعية المخترعة والعنصر الأخير تم تحضيره بـ 116 بيرتون في نواة كل ذرة ، ولم يتم حتى الآن تحديد أسماء هذه العناصر الصناعية.
المجموعة 2 في الجدول الدوري تسمى معادن الأرض القلوية مع إلكترونين في مداراتهم الخارجية.
يتم نشر الجدول الدوري بأشكال وأحجام مختلفة ، ولكن معظم الجداول الحديثة المستخدمة تبدأ بالمجموعة 1 ، تليها المجموعة 2 ، تليها مجموعة صفوف تتكون من 10 أعمدة تحتوي على 40 عنصرًا ، كل عمود يحتوي على 4 عناصر.
استخدامات الجدول الدوري الحديث للعناصر
يستخدم الجدول الدوري على نطاق واسع في العديد من الموضوعات المتعلقة بالكيمياء والفيزياء ، بما في ذلك:
- دراسة العناصر والخصائص الكيميائية والفيزيائية ومعرفة الفروق بينها.
- توقع خصائص العناصر وكيفية تفاعلها مع العناصر الأخرى.
خصائص العناصر
تنقسم العناصر الكيميائية إلى معادن ، ومعادن ، وشبه فلزات ، ولكل منها خصائصه الخاصة كما يلي:
أولاً: المعادن
تتميز المعادن بخصائصها الفيزيائية والكيميائية كالآتي:
1- الخصائص الفيزيائية
- تألق ولمعان.
- الموصلية الكهربائية والحرارة الجيدة.
- تتميز بكثافتها العالية.
- لديها نقطة انصهار عالية.
- يمكن سحبها عن الأسلاك.
- كلها صلبة باستثناء الزئبق.
2- الخواص الكيميائية
- تُفقد الإلكترونات بسهولة.
- تتآكل بسرعة.
ثانياً: اللافلزات
خصائص اللافلزات هي كما يلي:
1- الخصائص الفيزيائية
- ماتي وفضي.
- لا تسحب الكابلات.
- الموصلية الحرارية والكهربائية ضعيفة.
- لا تلمس الألواح.
- كثافته منخفضة.
- لديها نقطة انصهار منخفضة.
2- الخواص الكيميائية
- تميل إلى اكتساب الإلكترونات.
لمعرفة المزيد حول المعادن واللافلزات وخصائص كل منها ، نوصيك بمراجعة هذه المقالة: مقارنة بين المعادن واللافلزات ، وخصائص المعادن وخصائص اللافلزات
ثالثًا: أشباه الفلزات
خصائص الفلزات هي كما يلي:
- صلب.
- لامع أو غير لامع.
- يمكن سحبها عن الأسلاك.
- إنها موصلة للحرارة والكهرباء ، ولكنها ليست فعالة مثل المعادن.
- يمكن أن تضرب على الأرضيات.
لمعرفة ما يرمز إليه هذا العنصر الكيميائي ، نقترح عليك مراجعة المقالة: عنصر كيميائي برمز fe.
من هنا وبعد الاطلاع على أهم المعلومات الخاصة بالجدول الدوري الحديث للعناصر وخصائصه نصل إلى نهاية المقال ونتمنى أن ينال المقال رضاكم.