معادلات كيميائية موزونة مع الحل
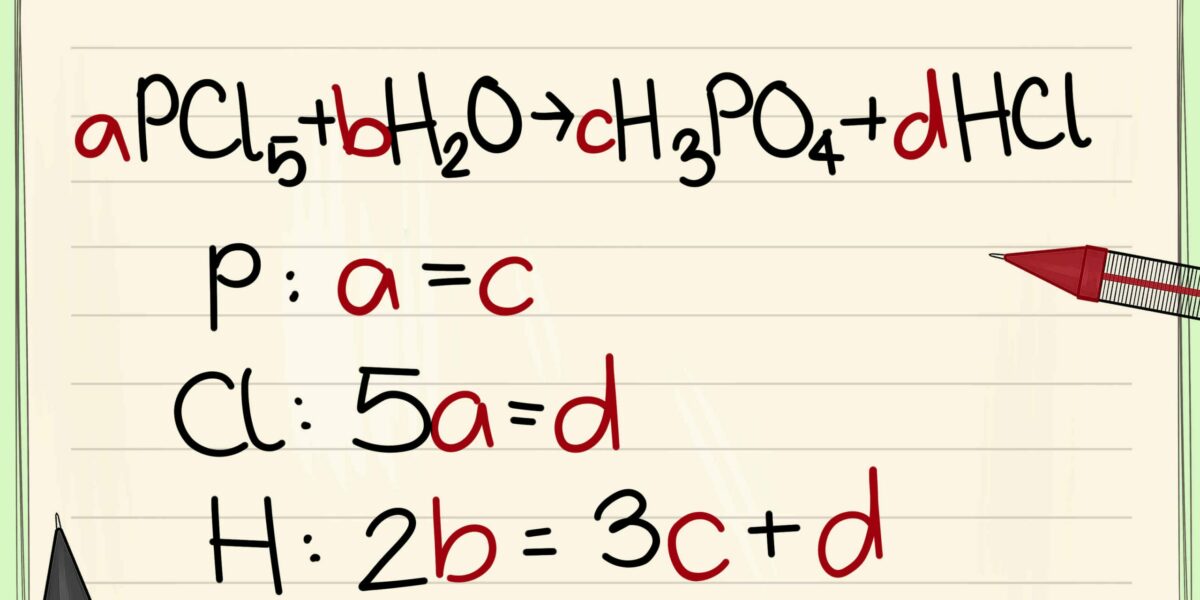
معادلات كيميائية متوازنة الحل سوف نقدمها لكم اليوم على موقع موجز مصر سوف نتعرف على سبب توازن المعادلات الكيميائية ، وسوف نتعرف على أنواع المعادلات الكيميائية ونقدم لكم بعض النصائح لموازنة المعادلات ، تابعونا. .
لمزيد من المعلومات ، اقرأ المزيد عن قوانين معدل التفاعل الكيميائي والعوامل التي تؤثر عليه.
المعادلات الكيميائية هي الأساس لاكتشاف عناصر جديدة وتحدث العديد من عمليات التفاعل في نفس الوقت لأنه من السهل على الكيميائيين تكوين معادلات كيميائية متوازنة بمحلول ، لكن هل تعرف ما هي المعادلة الكيميائية؟ هو:-
- رمز كيمياء يمثل أساس التفاعل بين العناصر.
- تحتوي المعادلة على عنصرين أو أكثر في تفاعل مع عوامل أخرى مثل العوامل المساعدة أو المحفزات أو البرودة أو الحرارة المتاحة.
- تتكون المعادلة الكيميائية من وجهين ؛ الطرف الأول نيابة عن المواد المتفاعلة ، والطرف الآخر نيابة عن نواتج التفاعلات ، وهي العناصر التي تشكلت بعد التفاعل.
- يجب تضمين مادتين أو أكثر في التفاعلات ، والموقف الذي يدخل فيه ما يصل إلى 90٪ من العناصر ليس هو نفسه مكان خروج العناصر.
- الكواشف على اليسار والمنتجات على اليمين.
- يوجد بين الكواشف والمنتجات سهم يشير إلى المنتج ويمكن كتابة العوامل الحفازة والحفازة على السهم.
- مثال لما تبدو عليه المعادلة الكيميائية عند دمج الهيدروجين مع الماء سيكون 2H2 + O2 -> 2H2O.
- ورد في المعادلة السابقة أن هناك أربع ذرات هيدروجين تتفاعل مع ذرتين من الأكسجين ، وبما أنه يتم استخلاص نفس العدد من الذرات على الجانب الأيمن من المنتج ، يجب أن تكون كمية المواد المتفاعلة مساوية للمنتج بأكمله. .
تقدم القراءة الإضافية مزيدًا من المعلومات حول نظرية الاصطدام ومعدل التفاعل الكيميائي والعوامل التي تؤثر عليه.
لماذا المعادلات الكيميائية متوازنة؟
كثير من الناس يسألون لماذا يجب أن تكون المعادلات الكيميائية متوازنة. إذا كانت المعادلة غير متوازنة ، فهل سيكون التأثير فعالاً؟ سنعرف الجواب كالتالي: –
- يجب إجراء موازنة المعادلة وعملية الموازنة هي العامل الأكثر أهمية إذا تمت مقارنة الموضوع.
- يتم ذلك وفقًا لقانون حفظ الكتلة ، حيث ينص هذا القانون على وجود عدد ذري معين قبل التفاعل أو قبل تفاعل المواد ، لذلك يجب أن يكون الرقم الذري هو نفسه الرقم الموجود في غير المنتجات. انخفاض أو زيادة أو مضاعفة الأعداد الذرية.
- تم تطوير قانون الكتلة بواسطة أنطوان لوريان عام 1789 م ، بعد العديد من التجارب تم اكتشاف أنه لا يمكن التلاعب بالمعادلة الكيميائية وأن المواد الكيميائية لن تتفاعل مع بعضها البعض حتى يتم وضع الكميات المناسبة. ضع أيضًا المواد المتفاعلة بنسب محددة لاستخراج المنتج المحدد. هذا يعني أن الأدوية لا يتم إنتاجها حتى يتم استخدام كميات مناسبة من المواد الكيميائية.
يمكنك الآن معرفة المزيد عن العوامل التي تؤثر على معدل وخصائص التفاعل الكيميائي.
طريقة معادلة التوازن الكيميائي
1- الطريقة الأولى لموازنة العناصر
- تكتب الصيغة الكيميائية لجميع المواد المتفاعلة الموجودة في الجانب الأيسر من المعادلة الكيميائية.
- ستدرج بعد ذلك المنتجات على اليمين.
- ثم يتم وضع السهم بين المعادلات.
- يتم جمع كل المواد المنتجة على الجانبين الأيمن والأيسر.
- ستجد أن هناك علامة زائد في جانب واحد ، والتي ستساعدك على ضبط المعادلات بدقة.
لمزيد من المعلومات ، اقرأ المزيد عن سرعة التفاعلات الكيميائية وقسم التفاعلات الكيميائية حسب سرعتها.
2- الطريقة الثانية لموازنة العناصر
- في هذه الطريقة ، سيتم تطبيق قانون حفظ الكتلة وينص قانون الكتلة على أن عدد الذرات في التفاعلات يجب أن يكون عدد الذرات في المنتجات.
- سوف تبحث عن العنصر الذي يتفاعل ويخرج.
- بمجرد أن يكون لديك توازن في ذلك ، ستوازن العنصر الآخر دون صعوبة.
- يتم حساب جميع المعادلات بنفس الطريقة.
تمنحك القراءة الإضافية مزيدًا من المعلومات حول العنصر الثاني الأكثر شيوعًا بعد الهيدروجين وخصائصه الفيزيائية والكيميائية.
3- الطريقة الثالثة لموازنة العناصر
- يجب ذكر فعالية المواد المنتجة في التفاعلات.
- يستخدم حرف خاص للمواد الغازية مثل الحرف G.
- بالنسبة للمواد السائلة ، فإن الحرف I.
- يشار إلى المواد الصلبة بالحرف S.
- إذا كنت تستخدم محلولًا مائيًا ، فسوف تقوم بإنشاء أكواد aq.
يمكنك الآن معرفة المزيد عن تفاعل الصوديوم مع الماء ، وخطوات إجراء التفاعل ، وأهم العوامل التي تنتج عنه.
نصائح لموازنة المعادلات
- يجب أن تتذكر جيدًا أنه عند موازنة المعادلات الكيميائية ، يمكنك تغيير قيم المعلمة أمام العنصر أو المركب وليس تغيير الرمز أدناه.
- يجب أن تعلم أن الأيونات متعددة في العدد الذري ، ويجب موازنة SO4 بدلاً من الأكسجين والكبريت ، على سبيل المثال ، بشكل منفصل.
- يجب أن تتذكر موازنة الأرقام مع عدد كبير من الذرات قبل القيام بأي شيء.
- بعد الانتهاء من المعادلة ، ستقوم بموازنة كل عنصر على الجانب الأيمن والأيسر للتأكد من وزن المعادلة.
اكتب المعادلة
خطوات كتابة المعادلة كالتالي:
- مبدئيًا ستحتفظ بجميع الأعداد الذرية في الجدول الدوري ، وعددها 111 عنصرًا في الجدول الدوري ، ويتم تسجيل كل عنصر لمعرفة الوزن بغض النظر عن وزن العدد الذري فيه. الكتاب.
- يحفظ جميع رموز العناصر لسهولة الترجيح والمعادلة.
- تكتب كل العناصر في المعادلة سواء كنت قد وزنت جانبي المعادلة أم لا.
- تحسب جميع الأعداد الذرية في الجانب الأيمن والأيسر.
- يمكنك بعد ذلك إجراء تعديل إذا وجدت أن الأرقام الذرية مختلفة عن الجانب الأيسر على اليمين.
- لن تستغرق المعادلة الموزونة الكثير من الوقت ، حيث يمكن للشخص الذي يحفظ الأرقام والرموز الذرية الحصول عليها في دقيقة واحدة كحد أقصى.
نوصي بالاطلاع على مزيد من المعلومات حول الأنواع الرئيسية للتفاعلات الكيميائية بشكل عام.
حل المعادلات الكيميائية المتوازنة
معادلة Zns + o2 -> zno + so2: في هذه المعادلة يدخل عنصر الزنك وحده مع الكبريت ، بينما يدخل الأكسجين برقمين ذريين ، وعندما يحدث التفاعل ، يخرج أكسيد الزنك بدون العدد الذري الإضافي ويظهر على الجانب الآخر يحتوي الأكسجين على رقمين ذريين والكبريت له رقم ذري ، أي أن المعادلة متوازنة ويمكن أن تكون المعادلة على النحو التالي zns + o2 -> 2zno + so2 ، ويتم وضع رقمين لضبط التوازن حيث توجد مجموعة مزدوجة على اليمين ، على الجانب الأيسر ، يتم وزن الأكسجين والكبريت على أنها 3zns + 3o2 -> 2zno + 2so2.
Pb (no3) 2 + nacl -> nano3 + pbcl2 معادلة: ستعامل المجموعة (no3) كما لو كانت مجموعة واحدة ومضاعفة على اليسار وفردية على اليمين ، والمعادلة هي: pb (no3) 2 + nacl -> 2nano3 + pbcl2 ، المجموعة يتم وضع الرقم الثاني ليكون (no3) على الجانب الأيمن وحتى على الجانب الأيسر.
يمكنك إضافة FeNo إلى ثلاثي أكسيد الصوديوم ، حيث إذا أضفت 2Fe (رقم 2) 3 إلى كلوريد الصوديوم ، يجب أن يكون وزن المعادلة مثل 3Na2 Co3 ، وستكون المعادلة على اليمين الوزن المناسب ، وستكون النتيجة يكون على الجانب بالإضافة إلى اليسار 6Nano3 ، Fe 2 (Co 3) f هو.
يضاف ثاني أكسيد الصوديوم أيضًا إلى الهيدروكلوريد بحيث يكون المنتج ثلاث مواد على النحو التالي ، حيث يضاف ثاني أكسيد الصوديوم إلى الهيدروكلوريك الذي يكون توازنه 2 هيدروكلورايد في التوازن التالي Na2 Co3 ، ويتم إنتاج مركب ثلاثي في المقاييس التالية. حيث يكون المركب الأول 2 Nacl والمركب الثاني Co2 والمركب الثالث H20.
لمزيد من المعلومات ، تعرف على المزيد عن الكيميائي العربي جابر بن حيان الملقب بـ “أبو الكيمياء”.
أنواع المعادلات الكيميائية
- تفاعل كيميائي مخلوط أو تفاعل خليط كيميائي مشترك.
- تفاعل التحليل الكيميائي أو تحلل المواد العضوية أو الصخرية أو غيرها من المواد.
- تفاعلات الاستبدال ، وهي تفاعلات يتم فيها استبدال العناصر الناتجة بعناصر تفاعلية.
- تعطي تفاعلات الاحتراق ، وهي تفاعلات يستخدم فيها النار ، نتائج مختلفة مع زيادة درجة الحرارة في التفاعل.
- تفاعل حمض مع قاعدة هي تفاعلات تنتج منتجًا محددًا ومعروفًا.
نوصيك بقراءة المزيد عن تأثيرات التفاعلات الكيميائية على البيئة وطرق تقليل التلوث البيئي.
في هذه المقالة ، قدمنا معادلات كيميائية متوازنة مع حل ، وتعلمنا سبب موازنة المعادلات الكيميائية ، وقدمنا لنا أنواعًا من المعادلات الكيميائية ، وقدمنا ثلاث طرق للعناصر التعويضية ، وقدمنا نصائح لموازنة المعادلات.